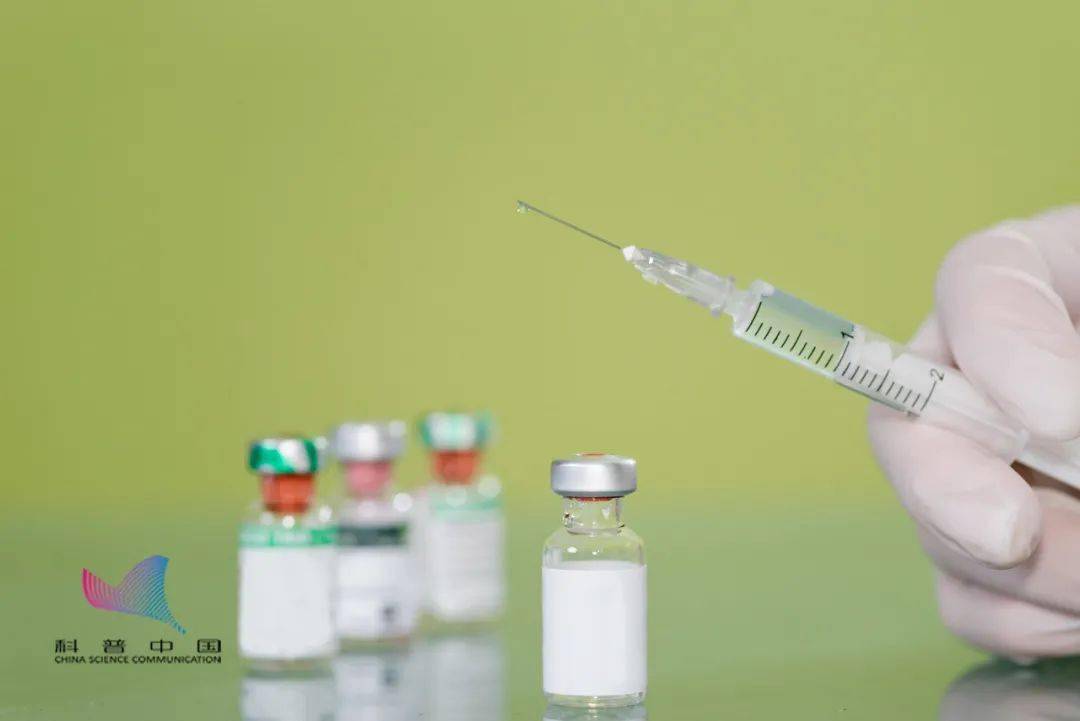
北京疫苗与武汉疫苗的区别,全面解析中国两大新冠疫苗的技术路线与特点
自新冠疫情爆发以来,中国在疫苗研发领域取得了举世瞩目的成就,其中北京生物制品研究所(国药集团中国生物)研发的灭活疫苗(BBIBP-CorV)和武汉生物制品研究所(国药集团中国生物)研发的灭活疫苗(WIBP-CorV)作为中国首批获批使用的新冠疫苗,在全球抗疫斗争中发挥了重要作用,尽管这两款疫苗同属灭活疫苗技术路线,且都由中国生物旗下研究所研发,但在生产工艺、临床试验数据、适用人群等方面仍存在一些值得关注的差异,本文将全面解析北京疫苗与武汉疫苗的区别,帮助公众更清晰地了解这两款中国自主研发的重要疫苗产品。
研发背景与基本情况
1 北京生物新冠疫苗(BBIBP-CorV)
北京生物制品研究所隶属于中国生物技术股份有限公司(国药集团中国生物),是中国历史最悠久的生物制品研究机构之一,北京生物新冠疫苗(BBIBP-CorV)于2020年4月12日获得国家药监局临床试验批件,是全球首个进入临床阶段的灭活新冠疫苗,2020年12月30日,该疫苗获得国家药监局附条件上市批准,成为中国首个获批上市的新冠疫苗。
2 武汉生物新冠疫苗(WIBP-CorV)
武汉生物制品研究所同样隶属于国药集团中国生物,作为中国重要的生物制品研发生产基地,在疫情期间承担了新冠疫苗研发的重要任务,武汉生物新冠疫苗(WIBP-CorV)于2020年4月12日与北京生物疫苗同日获得临床试验批件,2021年2月25日获得国家药监局附条件上市批准,成为中国第二个获批上市的国产新冠疫苗。
关键区别点:虽然两款疫苗同属国药集团中国生物旗下,且研发时间线相近,但北京生物疫苗的获批时间比武汉生物疫苗早了近两个月,这在一定程度上反映了北京生物疫苗的研发进度略快于武汉生物疫苗。
生产技术路线比较
1 灭活疫苗技术原理
北京疫苗和武汉疫苗均采用传统的灭活疫苗技术路线,这是目前最为成熟的疫苗制备技术之一,灭活疫苗的生产流程包括:病毒培养→灭活→纯化→添加佐剂→灌装等步骤,研发人员首先从患者体内分离出新冠病毒毒株,然后通过体外培养大量扩增病毒,再使用化学方法(如β-丙内酯)将病毒灭活,使其失去致病能力但保留免疫原性,最后添加佐剂制成疫苗。
2 北京疫苗与武汉疫苗的生产工艺差异
尽管两款疫苗同属灭活疫苗,但在具体生产工艺上仍存在一定差异:
-
病毒培养体系:北京生物疫苗采用Vero细胞(非洲绿猴肾细胞)培养新冠病毒,而武汉生物疫苗虽然也主要使用Vero细胞,但在病毒培养条件和培养基配方上有所不同,这可能导致病毒产量和抗原特性存在细微差别。
-
灭活工艺:两款疫苗虽然都使用β-丙内酯作为灭活剂,但在灭活时间、温度控制等参数上存在差异,北京生物的灭活工艺经过特别优化,据称能在保证病毒完全灭活的同时,更好地保留病毒表面蛋白的完整性。
-
纯化工艺:疫苗纯化是确保安全性的关键步骤,北京生物采用了多步层析纯化技术,包括分子筛层析和离子交换层析等;武汉生物则采用了略有不同的纯化工艺组合,两种方法在去除宿主细胞蛋白和DNA残留方面各有特点。
-
佐剂系统:两款疫苗均使用铝佐剂(氢氧化铝),但具体配方和添加比例有所不同,这可能影响疫苗的免疫原性和不良反应发生率。
关键区别点:生产工艺上的细微差异虽然不影响两款疫苗的基本性质,但可能导致它们在免疫效果和安全性方面表现出不同的特点。
临床试验数据对比
1 北京生物疫苗的临床试验结果
根据发表在《柳叶刀》上的北京生物疫苗Ⅲ期临床试验数据(在阿联酋、巴林等国开展):
- 保护效力:78.1%(对有症状COVID-19)
- 中和抗体阳转率:99.52%
- 重症保护率:100%
- 不良事件发生率:约21.9%,主要为轻度至中度反应(如注射部位疼痛、发热等)
2 武汉生物疫苗的临床试验结果
根据武汉生物疫苗在多个国家开展的Ⅲ期临床试验数据:
- 保护效力:72.8%(对有症状COVID-19)
- 中和抗体阳转率:98.6%
- 重症保护率:100%
- 不良事件发生率:约19.4%,不良反应类型与北京疫苗相似
关键区别点:从临床试验数据看,北京生物疫苗的保护效力略高于武汉生物疫苗(78.1% vs 72.8%),中和抗体阳转率也略高(99.52% vs 98.6%),武汉生物疫苗的不良反应发生率稍低(19.4% vs 21.9%),需要注意的是,这些差异在统计学上可能并不显著,且实际保护效果受多种因素影响。
获批情况及适用人群
1 北京生物疫苗的获批情况
北京生物新冠疫苗是中国首个获批上市的新冠疫苗,获批的接种人群最初为18-59岁成年人,后来扩展至3岁以上全年龄段,接种程序为2剂次,间隔3-4周,该疫苗还先后获得世界卫生组织(WHO)紧急使用认证和多个国家的注册批准。
2 武汉生物疫苗的获批情况
武汉生物新冠疫苗获批时间稍晚,最初获批用于18-59岁人群,后来也扩展至3岁以上人群,接种程序同样为2剂次,间隔3-4周,武汉疫苗也获得了WHO紧急使用认证,但获批国家数量略少于北京疫苗。
关键区别点:两款疫苗在适用人群和接种程序上基本相同,主要区别在于北京疫苗的国际认可度略高,获批国家更多,这可能与北京疫苗的临床试验数据公布更早、更全面有关。
实际接种中的混合使用问题
在中国的大规模疫苗接种过程中,由于疫苗供应和调配的需要,有时会出现第一针接种北京疫苗、第二针接种武汉疫苗的情况,针对这种混合接种的效果,中国疾控中心专家表示:
-
技术同源性:由于两款疫苗同属灭活疫苗,且生产工艺相似,理论上混合接种不会带来安全性问题。
-
免疫效果:初步研究显示,北京疫苗和武汉疫苗交替接种后,中和抗体水平与同种疫苗两剂接种相当,未发现免疫效果明显降低的情况。
-
官方建议:在疫苗供应充足的情况下,仍建议使用同一厂家疫苗完成全程接种;只有在特殊情况下(如第一针接种后出现供应中断),才考虑混合接种。
关键区别点:虽然两款疫苗可以应急混种,但从免疫学角度考虑,完整接种同一厂家的疫苗仍是首选方案。
国际认可与全球使用情况
1 北京生物疫苗的全球使用
北京生物新冠疫苗是首个被列入WHO紧急使用清单的中国新冠疫苗,截至2022年底,已在超过100个国家和地区获批使用,成为全球范围内使用最广泛的中国疫苗,该疫苗还被纳入全球"新冠肺炎疫苗实施计划"(COVAX)的疫苗库。
2 武汉生物疫苗的全球使用
武汉生物新冠疫苗也获得了WHO紧急使用认证,但获批国家数量相对较少,约50多个国家和地区批准使用,在国际市场上的占有率略低于北京生物疫苗。
关键区别点:在国际认可度和全球使用范围方面,北京生物疫苗明显领先于武汉生物疫苗,这主要得益于北京疫苗更早完成Ⅲ期临床试验并公布数据,以及国药集团在国际推广中的资源倾斜。
存储与运输条件
1 北京生物疫苗的存储要求
北京生物新冠疫苗需要在2-8℃的环境下储存和运输,保质期暂定为24个月,这种常规冷链要求使得该疫苗非常适合在发展中国家和基础设施较差的地区推广使用。
2 武汉生物疫苗的存储要求
武汉生物新冠疫苗同样要求在2-8℃条件下储存,但根据产品说明书,开封后的使用时限略有不同,两款疫苗在冷链要求方面基本相同,都无需超低温储存。
关键区别点:在存储条件方面,两款疫苗几乎没有区别,都具备良好的热稳定性和便利的冷链要求,这是灭活疫苗相对于mRNA疫苗的一大优势。
产能与供应情况
1 北京生物疫苗的产能
北京生物新冠疫苗的原液年产能超过30亿剂,是中国产能最大的新冠疫苗之一,北京生物还通过技术转移,在全国多个省市建立了分包装基地,进一步扩大了供应能力。
2 武汉生物疫苗的产能
武汉生物新冠疫苗的年产能约为20亿剂,略低于北京生物,通过国药集团的统一调配,两款疫苗的供应基本能满足国内外需求。
关键区别点:北京生物疫苗的产能更大,这使其成为中国向国际社会提供疫苗援助的主力产品,武汉生物疫苗则更多用于满足国内接种需求。
针对变异株的效果
随着新冠病毒的不断变异,疫苗对变异株的保护效果备受关注,研究显示:
-
北京生物疫苗:对原始毒株和Alpha变异株保护效果良好,对Delta变异株的保护效果有所下降(但仍能有效预防重症),对Omicron变异株的中和活性显著降低。
-
武汉生物疫苗:对变异株的表现与北京疫苗相似,但个别研究显示武汉疫苗对某些变异株的中和抗体滴度下降幅度略小,这可能与生产工艺差异导致的抗原表位保留不同有关。
针对变异株的威胁,两家研究所都在开发针对Omicron等变异株的二代疫苗或加强针方案。
关键区别点:面对病毒变异,两款疫苗的表现总体相似,但在针对某些特定变异株时可能存在细微差异,这需要更多研究数据来验证。
总结与建议
经过全面比较,我们可以总结出北京生物新冠疫苗(BBIBP-CorV)和武汉生物新冠疫苗(WIBP-CorV)的主要区别:
-
研发进度:北京疫苗获批时间更早(2020年12月 vs 2021年2月)。
-
保护效力:北京疫苗的Ⅲ期临床试验显示的保护效力略高(78.1% vs 72.8%)。
-
国际认可:北京疫苗获得更多国家批准,全球使用更广泛。
-
产能规模:北京疫苗的年产能更大(30亿剂 vs 20亿剂)。
-
不良反应:武汉疫苗的不良反应发生率略低(19.4% vs 21.9%)。
对于普通公众的选择建议:
-
两款疫苗都是安全有效的,接种时不必刻意选择某一特定产品。
-
在可能的情况下,尽量完成同一厂家疫苗的全程接种。
-
关注当地疾控部门的最新接种建议,特别是针对加强针的政策。
-
无论接种哪款疫苗,都应继续坚持戴口罩、保持社交距离等防护措施。
中国同时研发多款新冠疫苗的战略,不仅提高了疫苗供应的保障能力,也为应对病毒变异提供了更多选择,北京疫苗和武汉疫苗作为中国灭活疫苗的代表,在全球抗疫中发挥了不可替代的作用,它们的研发和应用经验也将为未来传染病防控提供宝贵参考。





发表评论