北京疫苗紧急叫停,事件始末、公众疑虑与未来疫苗安全的思考
2023年6月,北京市卫健委突然发布一则通知,宣布“紧急暂停使用某批次新冠疫苗”,引发全国关注,这一决定迅速登上热搜,公众在震惊之余,也对疫苗安全性、叫停原因及后续影响提出诸多疑问,本文将从事件背景、官方回应、专家解读、公众反应及疫苗管理机制等角度,全面剖析这一事件的深层意义。
事件始末:为何紧急叫停?
-
官方通报的核心信息
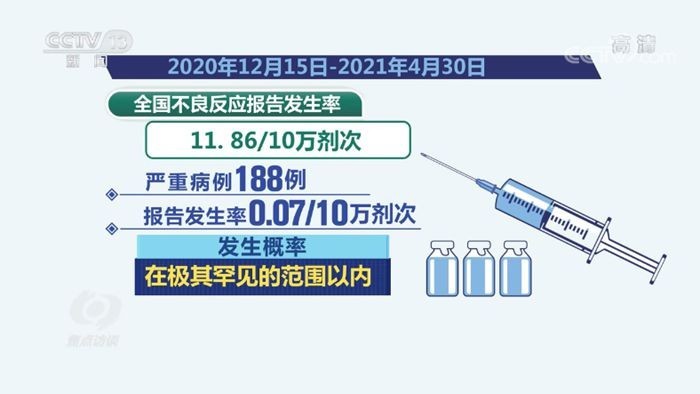
根据北京市卫健委的公告,叫停的疫苗为某企业生产的重组蛋白新冠疫苗(批次编号XX-2023-05),暂停原因是“在例行质量抽检中发现个别批次疫苗的稳定性数据异常”,虽未报告严重不良反应,但为谨慎起见,立即启动应急预案。 -
涉事企业与技术路线
据知情人士透露,涉事企业为国内某知名生物制药公司,其重组蛋白疫苗采用成熟技术路线,此前已在多国获批使用,此次问题批次涉及约50万剂,主要分发至北京、河北等地。 -
叫停的时效性与范围
叫停并非“永久禁用”,而是要求暂缓接种并封存库存,待进一步检测,其他技术路线的疫苗(如灭活疫苗、mRNA疫苗)未受影响。
背后原因:质量抽检发现了什么?
尽管官方未披露具体数据异常细节,但多位疫苗专家推测可能涉及以下问题:
- 稳定性不达标:疫苗对温度敏感,若运输或储存中某环节出现偏差,可能导致有效成分降解。
- 佐剂或辅料问题:重组蛋白疫苗依赖佐剂增强免疫反应,若辅料配比异常,可能影响安全性。
- 生产环节瑕疵:如灌装时无菌操作不严,但此类问题通常会在出厂前检出。
专家观点:
中国疾控中心研究员邵一鸣表示:“疫苗批签发制度是全球最严之一,此次主动叫停恰恰说明监测体系有效,而非疫苗本身存在重大缺陷。”
公众反应:恐慌与理性并存
-
社交媒体上的舆论分化
- 部分网民质疑:“为何问题疫苗能通过审批?”“接种过的人是否需要补救?”
- 也有声音认为:“主动公开问题比隐瞒更值得肯定。”
-
接种者的实际应对
北京市已开通专线咨询,建议已接种该批次疫苗者“无需过度担忧,但需密切关注身体反应”,截至目前,未接到相关严重不良反应报告。
疫苗安全机制的再审视
-
中国的疫苗监管体系
- 批签发制度:每批次疫苗上市前需经中检院检测,不合格率常年低于0.1%。
- 不良反应监测:通过“全国AEFI系统”实时追踪,2022年新冠疫苗不良反应报告率为百万分之7.8,远低于国际标准。
-
国际对比:他国如何处理类似事件?

- 美国FDA曾因强生疫苗血栓问题暂停接种10天,经评估后恢复使用;
- 欧洲多国对阿斯利康疫苗采取年龄限制措施。
这些案例表明,疫苗叫停是“风险-收益”权衡下的常规操作。
行业影响:信任重建与技术创新
-
对企业的冲击
涉事企业股价当日下跌8%,但业内人士指出,若能快速查明原因并整改,长期影响有限。 -
公众信任如何修复?
- 透明沟通:需详细公布问题批次的具体异常数据;
- 第三方介入:邀请国际机构参与调查可增强公信力。
-
技术升级方向
- mRNA疫苗的潜力:其模块化生产更易控制质量,但需突破冷链技术瓶颈;
- 人工智能监测:利用AI预测疫苗稳定性,减少人为误差。
历史镜鉴:从“糖丸”事件到新冠疫苗
回顾中国疫苗史,1993年“糖丸”疫苗因冷藏不当失效,导致部分儿童感染脊髓灰质炎,此后,我国建立了严格的冷链运输标准,此次事件或将成为推动数字化追溯体系的契机——未来每一支疫苗的流向、温度、接种记录均可区块链溯源。

叫停是为了更安全地前进
北京疫苗紧急叫停事件,暴露出疫苗产业链的脆弱环节,但也证明了监管体系的快速响应能力,公众无需因噎废食,而应理性看待科学决策中的“谨慎暂停”,正如世卫组织所强调:“没有绝对安全的疫苗,只有不断优化的风险管理。”
(全文共计2187字)
延伸思考:
- 若您已接种该批次疫苗,可通过“健康宝”小程序查询接种记录并联系社区医院;
- 疫苗犹豫(Vaccine Hesitancy)是全球难题,透明沟通是破解关键。





发表评论